EDIÇÃO 9 – Agosto 2025
EDIÇÃO 9 – Agosto 2025
Além das Fronteiras: o que aprendemos em Montreal e Harvard

Observership – Universidade de Montreal
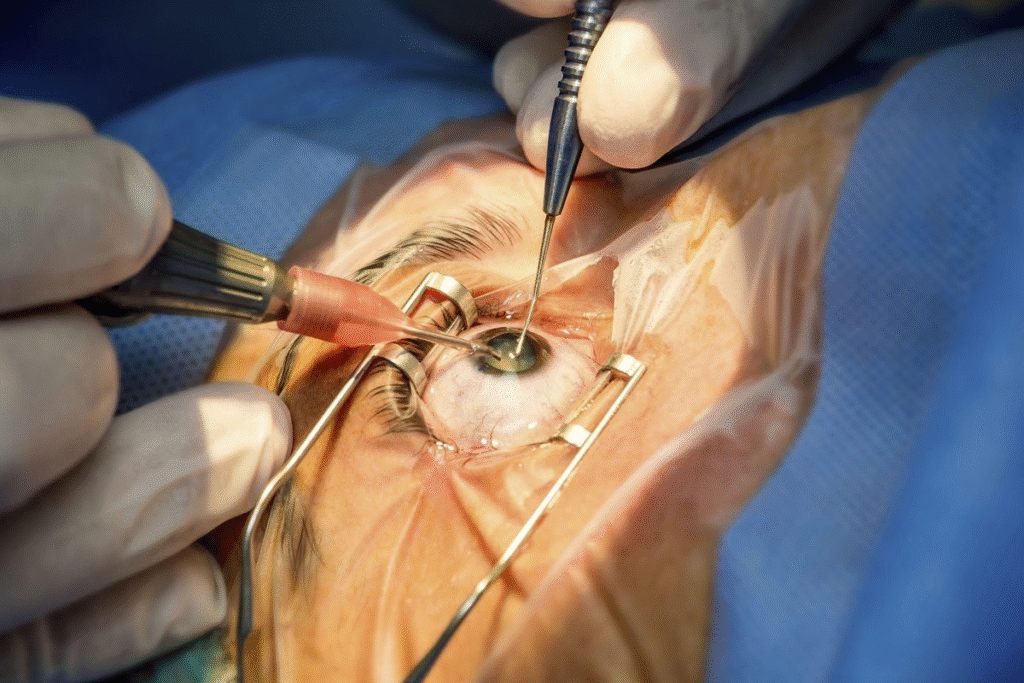
Por: Bruno Santana Ao final do segundo ano da residência médica, busquei ampliar minha formação por meio de uma experiência internacional. Passei 15 dias em Montreal, acompanhando o serviço de retina da Universidade de Montreal sob a supervisão do Dr. Flavio Rezende, referência mundial na área. Estar próximo ao Dr. Flavio foi decisivo, tanto pela relevância de sua contribuição científica quanto pela oportunidade de observar sua rotina de trabalho em um centro de referência. Ao longo do observership, vivenciei intensamente o dia a dia da retina cirúrgica, acompanhando procedimentos complexos e desafiadores que ampliaram meu raciocínio clínico e minha visão sobre tecnologia aplicada ao cuidado ocular. Também pude observar a relação médico-paciente conduzida de forma humana e empática, mesmo em cenários de alta complexidade. Mais do que aprendizado técnico, a experiência me trouxe uma perspectiva global: o contato com colegas de diferentes países, cada um com sua realidade e forma de atuar, ampliou meu entendimento sobre a oftalmologia e enriqueceu minha formação. Foi um período que expandiu horizontes e mostrou o valor de buscar vivências fora do nosso ambiente habitual, algo que pode transformar a trajetória de qualquer residente. Observership – Mass Eye and Ear / Harvard Medical School
Por: Matheus Pacheco A experiência no Mass Eye and Ear foi de grande valor na minha trajetória. O desejo de ter uma experiência internacional sempre esteve presente em mim, porém não foi possível realizar durante a faculdade de medicina. Durante a residência, no entanto, não deixaria essa oportunidade passar. No início do R2, conversei com minha chefe de residência sobre possíveis lugares e escolhemos Harvard para tentar o estágio. Ela tinha o contato de um dos chefes do setor de Córnea de Harvard (uma das minhas principais áreas de interesse), enviou uma mensagem e ele prontamente respondeu com algumas orientações sobre o processo necessário para obter o estágio. Após alguns envios de documentos e trocas de e-mails, ficou firmado: iria realizar meu sonho antigo de conhecer o serviço de oftalmologia de Harvard por dentro. A experiência foi enriquecedora do começo ao fim. Ainda que a oftalmologia praticada nos EUA atualmente seja bastante similar à do Brasil, o simples fato de estar em Harvard, com toda sua grandiosidade e tradição, impressiona. Foram dias de imersão, onde chegava às 6h30 e muitas vezes saía às 20h30. Um grande volume de cirurgias e atendimentos, com pacientes referenciados de diversos estados dos Estados Unidos para avaliação. Vivenciei principalmente cirurgias de alta complexidade do segmento anterior, transplantes, reposicionamentos de LIOs, fixações secundárias, pupiloplastias — tudo no mais alto nível. A troca com fellows e residentes de lá também foi muito enriquecedora, proporcionando uma troca cultural e de experiências valiosa. O fato de estar lá por um período curto, cerca de 10 dias, despertou ainda mais meu entusiasmo para aproveitar meu tempo ao máximo. Fiquei sempre disponível, muitas vezes ficava até mais tarde, solicitei participar de outras atividades, e todos foram muito receptivos, incentivando essa postura. Tive a oportunidade de participar de reuniões restritas com chefes, fellows e residentes de Harvard, vendo de perto o nível de discussão por lá. Também pude participar de um jantar com apresentações sobre inovações e o futuro do tratamento de ceratocone — coisas impensáveis se tivesse seguido apenas a escala tradicional que me foi passada. Acredito que essa experiência não apenas realizou um sonho antigo, mas também criou novas metas e expectativas. O caminho na oftalmologia pode ser construído de várias formas, e essas pequenas experiências estimulam e renovam as energias. Encorajo todos os residentes com quem converso a buscarem uma experiência como essa. Fazendo uma autoanálise, considero o R2 um momento ideal para buscar esse estágio: é um período em que o residente já possui uma boa bagagem em oftalmologia e ainda não enfrenta as preocupações do R3, relacionadas à prova de título ou ao processo de fellowship, podendo vivenciar essa experiência de forma plena e sem grandes preocupações. Como dicas finais:
Por: Bruno Santana Ao final do segundo ano da residência médica, busquei ampliar minha formação por meio de uma experiência internacional. Passei 15 dias em Montreal, acompanhando o serviço de retina da Universidade de Montreal sob a supervisão do Dr. Flavio Rezende, referência mundial na área. Estar próximo ao Dr. Flavio foi decisivo, tanto pela relevância de sua contribuição científica quanto pela oportunidade de observar sua rotina de trabalho em um centro de referência. Ao longo do observership, vivenciei intensamente o dia a dia da retina cirúrgica, acompanhando procedimentos complexos e desafiadores que ampliaram meu raciocínio clínico e minha visão sobre tecnologia aplicada ao cuidado ocular. Também pude observar a relação médico-paciente conduzida de forma humana e empática, mesmo em cenários de alta complexidade. Mais do que aprendizado técnico, a experiência me trouxe uma perspectiva global: o contato com colegas de diferentes países, cada um com sua realidade e forma de atuar, ampliou meu entendimento sobre a oftalmologia e enriqueceu minha formação. Foi um período que expandiu horizontes e mostrou o valor de buscar vivências fora do nosso ambiente habitual, algo que pode transformar a trajetória de qualquer residente. Observership – Mass Eye and Ear / Harvard Medical School
Por: Matheus Pacheco A experiência no Mass Eye and Ear foi de grande valor na minha trajetória. O desejo de ter uma experiência internacional sempre esteve presente em mim, porém não foi possível realizar durante a faculdade de medicina. Durante a residência, no entanto, não deixaria essa oportunidade passar. No início do R2, conversei com minha chefe de residência sobre possíveis lugares e escolhemos Harvard para tentar o estágio. Ela tinha o contato de um dos chefes do setor de Córnea de Harvard (uma das minhas principais áreas de interesse), enviou uma mensagem e ele prontamente respondeu com algumas orientações sobre o processo necessário para obter o estágio. Após alguns envios de documentos e trocas de e-mails, ficou firmado: iria realizar meu sonho antigo de conhecer o serviço de oftalmologia de Harvard por dentro. A experiência foi enriquecedora do começo ao fim. Ainda que a oftalmologia praticada nos EUA atualmente seja bastante similar à do Brasil, o simples fato de estar em Harvard, com toda sua grandiosidade e tradição, impressiona. Foram dias de imersão, onde chegava às 6h30 e muitas vezes saía às 20h30. Um grande volume de cirurgias e atendimentos, com pacientes referenciados de diversos estados dos Estados Unidos para avaliação. Vivenciei principalmente cirurgias de alta complexidade do segmento anterior, transplantes, reposicionamentos de LIOs, fixações secundárias, pupiloplastias — tudo no mais alto nível. A troca com fellows e residentes de lá também foi muito enriquecedora, proporcionando uma troca cultural e de experiências valiosa. O fato de estar lá por um período curto, cerca de 10 dias, despertou ainda mais meu entusiasmo para aproveitar meu tempo ao máximo. Fiquei sempre disponível, muitas vezes ficava até mais tarde, solicitei participar de outras atividades, e todos foram muito receptivos, incentivando essa postura. Tive a oportunidade de participar de reuniões restritas com chefes, fellows e residentes de Harvard, vendo de perto o nível de discussão por lá. Também pude participar de um jantar com apresentações sobre inovações e o futuro do tratamento de ceratocone — coisas impensáveis se tivesse seguido apenas a escala tradicional que me foi passada. Acredito que essa experiência não apenas realizou um sonho antigo, mas também criou novas metas e expectativas. O caminho na oftalmologia pode ser construído de várias formas, e essas pequenas experiências estimulam e renovam as energias. Encorajo todos os residentes com quem converso a buscarem uma experiência como essa. Fazendo uma autoanálise, considero o R2 um momento ideal para buscar esse estágio: é um período em que o residente já possui uma boa bagagem em oftalmologia e ainda não enfrenta as preocupações do R3, relacionadas à prova de título ou ao processo de fellowship, podendo vivenciar essa experiência de forma plena e sem grandes preocupações. Como dicas finais:
- Procure um mentor que possa ajudá-lo a conquistar o estágio;
- Se não tiver, visite os sites das instituições e tente contato direto com os e-mails dos chefes ou responsáveis. É um caminho um pouco mais difícil, mas totalmente viável;
- Aproveite ao máximo sua estadia lá. Fique mais tempo, seja curioso, pergunte, e as oportunidades surgirão;
- Mantenha os contatos criados e construa seu networking.
Autores:
- Matheus Pacheco – R3 Oftalmologia – BOS
- Bruno Santana – R3 Oftalmologia – IAMSPE